PH-test med salter och Lactol
 Bakgrund
Bakgrund
En stor nackdel med att brygga med bryggverk som har pumpar (men även med BIAB) är den stora mängden vatten som krävs i mäsken för att bryggverket ska fungera. Vattenmängden i sin tur ger ett högre pH i mäsken än vad enzymerna föredrar. Detta justerar man via vattenbehandling med salter, mjölksyra (Lactol) eller ibland fosforsyra vilket dock är lite svårare att få tag på i Sverige. Jag som tycker om att brygga ganska ljusa öl får dock stora problem att nå mitt önskade pH med enbart salter men faktum är att inte ens den rekommenderade maxmängden mjölksyra för att komma ner i pH 5.2-5.4 räcker. John Palmer menar att under 250 mg/l märks inte smaken av mjölksyra i ölet medan Kai Troester (Braukaiser) som gjort smaktester på detta kommit fram till att man kan komma undan med uppåt 400 mg/l (övre smakgräns) (1) något som Brülosphy konfirmerar (2). Även Jeff Sparrow nämner samma siffra i sin bok Wild Brews; “The human palate can recognize lactic acid at 400 parts per million…” (3).
Det experiment jag redovisar för nedan är varken gjort för att testa smaken på mjölksyra eller smakgränsen/tröskelvärdet för att känns smaken av mjölksyra utan för att testa hur mycket mer än de 20 ml jag brukar tillsätta som skulle krävas för att gå från 5.6 till 5.2-5.3 eller vad jag nu siktar på. Vad som är det perfekta mäskpH:t tänker jag inte heller diskutera i detta test för det finns en rad olika teorier beroende på vem man frågar, Kai Troester på Braukaiser.com tycker 5.4-5.6 är ett bra spann medan Wolfgang Kuntze tycker att 5.2-5.4 är lämpligt. John Palmer däremot tycker att; “…for best results, the mash pH should be (…) 5.4 to 5.8 when measured at room temperature.” (4) medan författarna av Brewing: Science and Practice tycker att ”Infusion mashes are best carried out at (…) pH values of about 5.5 5.8.” (5). Vi lämnar diskussionen kring optimalt mäskpH därhän och går vidare.
Linjär ekvation
Det som både uträkningar i Wolfgang Kunzes bok Technology brewing and malting (6) och Beersmith hävdar är att ekvation för pHsänkningen med mjölksyra är linjär dvs att en bestämd mängd mjölksyra sänker pH:t i mäsken lika mycket oavsett startvärde. T.ex. om 3 ml mjölksyra sänker pH 0.1 från 5.9 till 5.8 så kommer 3 ml sänka pH från 4.2 till 4.1. För mig känns detta inte rimligt eftersom mjölksyra är en ganska svag syra. Beersmith säger att jag i mina fullstora batcher (11kg extraljus pilsnermalt och 60l mäskvatten) ska tillsätta 4,6ml 80%-ig Lactol för varje 0,1 i pHsänkning jag vill uppnå, oavsett om startpH är 6.0 eller 5.0. Nu kommer testa test att fokusera på mjölksyra men andra sätt att sänka pH redovisas på samma sätt dvs. 0.1 i pH per kilo oavsett startvärde:
För att sänka 0.1 pH/kg krävs:
Lactol 0.25-0.42ml
Syramalt 9-15g
Fosforsyra (10% styrka) 2.94-3,92ml
Fosforsyra (85% styrka) 0.2-0.27ml
Gypsum CaSO4 1-1.3g
CaCl 0.9-1.1g
Dessa siffror som jag tyvärr tappat källan till är förvisso inom ett spann men utgår inte från att det skulle vara skillnad på startvärde…
Frågeställning
Hur mycket sjunker pH:t på min mäsk, med min malt och mitt saltbehandlade vatten, genom att tillsätta 80%-ig mjölksyra och är denna sänkning linjär?
Metod
Min metod för att testa detta var att göra en minimäsk som fick 5 kontrollerade mängder mjölksyra för att mäta pHsekvensen på. För att hamna på en för testet smidig nivå delade jag min normala batchsize på 60 vilket gav en inmäskningsvattenmängd på 1 liter vid 20c eller 1000 gram. Med en standardmängd på 11 kg malt för att nå cirka 12 plato (1.048 ö) efter kok, delat på 60 hamnade jag på 183 gram basmalt vilket i mitt fall är Weyermanns extra ljusa premium pilsnermalt. Även min uträknade mängd Kalcium för 100 ppm delades på 60 vilket gav 0,42 gram KalciumKlorid (CaCl2). Jag värmde upp mäskvattnet till 66c och tillsatte Kalciumkloriden. Sedan tillsatte jag den nykrossade malten, rörde runt ordentligt och väntade en stund innan jag mätte start-pH:t, nollvärdet. Sen tillsatte jag 0,5 ml Lactol i taget fem gånger och tog varje gång ett nytt prov som kyldes till 20c för pHmätning innan provet återfördes till huvudmäsken.
 1000 gram vatten vägdes upp istället för att mäta en liter då det inte är 20c som kommer ut kranen.
1000 gram vatten vägdes upp istället för att mäta en liter då det inte är 20c som kommer ut kranen.
 Vattnet värmdes till 66c före inmäskning.
Vattnet värmdes till 66c före inmäskning.
 183 gram basmalt före krossning.
183 gram basmalt före krossning.
 Krossning på 1.0mm mätt med bladmått.
Krossning på 1.0mm mätt med bladmått.
 183 gram basmalt efter krossning.
183 gram basmalt efter krossning.
 0,42 gram Kalciumklorid. Hur noggrann denna billiga våg är låter jag vara osagt men mängden CaCl är inte avgörande för testresultatet.
0,42 gram Kalciumklorid. Hur noggrann denna billiga våg är låter jag vara osagt men mängden CaCl är inte avgörande för testresultatet.
 Saltet ca 10 sekunder efter det tillsatts i 66c vatten.
Saltet ca 10 sekunder efter det tillsatts i 66c vatten.
 En lätt vispning i vattnet ch 10 sek till löste upp saltet nästan helt.
En lätt vispning i vattnet ch 10 sek till löste upp saltet nästan helt.
 Noggrann inmäskning.
Noggrann inmäskning.

 Kylning av två stora beyggslevar mäsk för första pHmätning.
Kylning av två stora beyggslevar mäsk för första pHmätning.
 pH 6.1 på enbart vatten, malt och CaCl. Provet återfördes till huvudmäsken för att inte ändra mäskvolymen för varje prov. Mäsken värmdes upp till 66c efter varje gång.
pH 6.1 på enbart vatten, malt och CaCl. Provet återfördes till huvudmäsken för att inte ändra mäskvolymen för varje prov. Mäsken värmdes upp till 66c efter varje gång.
 0,5 ml 88%ig mjölksyra dvs. Lactol.
0,5 ml 88%ig mjölksyra dvs. Lactol.
 Nytt prov kyldes i kallvattenbad till ca 20c och proceduren upprepades totalt 5 gånger.
Nytt prov kyldes i kallvattenbad till ca 20c och proceduren upprepades totalt 5 gånger.




Mätdata
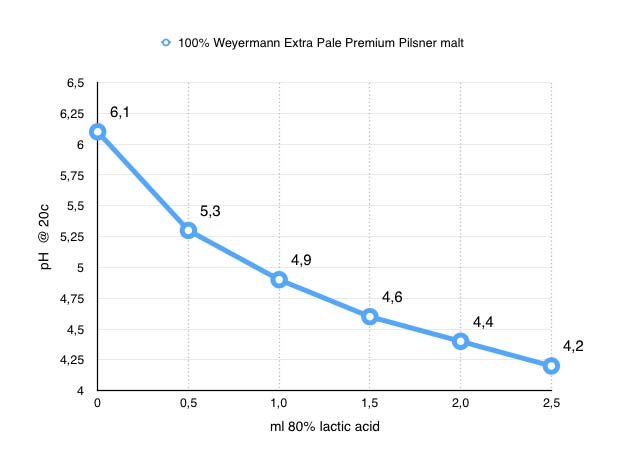
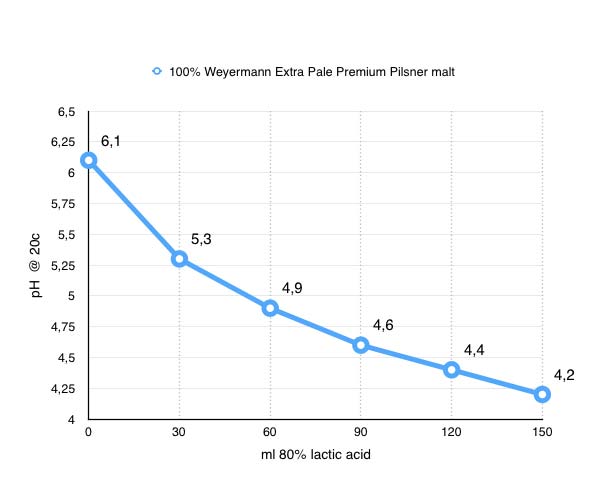
0.0 ml = pH 6,1 (Startvärde)
0,5 ml = pH 5.3 (-0.8)
1.0 ml = pH 4.9 (-0.4)
1.5 ml = pH 4.6 (-0.3)
2.0 ml = pH 4.4 (-0.2)
2.5 ml = pH 4.2 (-0.2)
Resultat
Med detta test har jag visat att pH inte sjunker linjärt utan avtagande beroende på mäskens pH.
Diskussion & felkällor
Även om jag försökt vara noggrann vid detta test är detta långt ifrån en vetenskapligt bevisad slutsats men jag tycker ändå att det blev tillräckligt tydligt för att på hobbynivå dra slutsatsen jag länge misstänkt, att pH sjunker mindre per ml mjölksyra ju lägre mäskens pH är. Nedanstående graf visar att jag med mina tidigare 20 ml mjölksyra hamnar på ca 5.5 i pH vilket är ungefär vad jag hamna i när jag bryggt senaste gångerna och att 10 ml ytterligare skulle krävas för att komma ner i pH 5.3. Nu återstår att testa om jag känner av den höga mängden mjölksyra och om jag ska byta till en mer normalt färgad basmalt, installera mitt RO-filter eller köpa fosforsyra. Men det är en annan blogg post det…
Referenser
1. Troester, Kai ”Lactate taste threshold experiment”, http://braukaiser.com/wiki/index.php?title=Lactate_Taste_Threshold_experiment
2. http://brulosophy.com/2016/05/09/water-chemistry-pt-4-phosphoric-vs-lactic-acid-for-mash-ph-adjustment-exbeeriment-results/
3. Sparrow, Jeff. “Wild Brews” s.151
4. John J. Palmer. “How to Brew: Everything You Need to Know to Brew Beer Right the First Time.” Kapitel Understanding Mash pH
5. Briggs, Brookes, Stevens, Boulton. ”Brewing: Science and Practice” s.131
6. Kunzes, Wolfgang ”Technology brewing and malting” s.227
 Du har väl inte missat min bok om ölbryggning? Köp den hos Humlegården!
Du har väl inte missat min bok om ölbryggning? Köp den hos Humlegården!


Trevligt med lite bryggvetenskap!
Nu är jag väldigt trött och så så jag kan ha missat något men jag tycker det ser rätt väntat ut eftersom pH just är logaritmiskt definierat. Om jag minns rätt är det 10-logaritmen av antal vätejoner (H+ / H3O+), vilket ju ökar linjärt med mängden mjölksyra du tillsätter (mol brukar man mäta det i, men volym i det här fallet). Var några år sen jag var tvungen att räkna sånt här så kan som sagt ha missat något, men vore ju intressant att se om dina logaritmerade värden blir linjära om du ”avlogartimerar” dem (10^x). Misstänker att det finns några buffrar som jobbar emot och att det ändå inte blir linjärt men jag vet inte.
Det ligger någonting i det du säger. Men om skalan är logaritmisk och upphöjt i tio så borde grafen vara linjär precis som du skriver. Men om man jämför med vatten så skulle hundragradigt vatten sjunka ner om man har isvatten än om man har i 50 gradigt vatten. Min tanke är att mjölksyran inte är tillräckligt sur i jämförelse med tex saltsyra men det resonemanget spricker ju om man pratar om tillsatta vätejoner. Det jag själv märkt när jag tillsatt till exempel 15 ml mjölksyra och fått 0,3 i sänkning är att om jag tillsätter 15 ml till så sjunker inte mäsken lika mycket i PH. Därför fick jag för mig att göra detta test. Och mycket riktigt betedde sig mäsken på det sätt jag trodde. Mätfel eller inte så besannades mina misstankar men någon bättre kemikunskaper får gärna rätta mig.
Trevligt experiment som sagt. Hur mycket pH sänks vid given tillsatts mjölksyra är resultatet av en mängd variabler. Precis som Joel skriver mäts pH på log-skala, mer specifikt är det det negativa log10 värdet av aktiviteten (effektiva koncentrationen) av H3O+ joner i vatten, mätt i molar (M, dvs mol/L). Alltså kommer det i ett obuffrat system (exempelvis avjonat vatten) krävas 10 gånger mer tillsatta vätejoner varje steg nedåt i skalan vi sänker pH värdet.
Ex. Sänk pH i 1L avjonat vatten från 7 till 6, och sen från 6 till 5 , med 1M saltsyra.
Saltsyran är en stark syra och kommer alltså vara fullständigt dissocierad till Cl- och H3O+. För att sänka pH värdet från 7 till 6 måste vi tillsätta 10-6 – 10^-7 mol H3O+, vilket är ca 10^-6 mol. Volymen saltsyra blir då 10^-6/1 = 10^-6 L, dvs 0.001 mL
För att sänka pH värdet från 6 till 5 måste vi tillsätta 10-5 – 10^-6 mol H3O+, vilket är ca 10^-5 mol. Volymen saltsyra blir då 10^-5/1 = 10^-6 L, dvs 0.01 mL.
Som synes kan vi fortsätta att tillsätta större och större volymer av saltsyra tills vi når ett pH = 1, mer äns så kan vi inte sänka med 1M saltsyra eftersom den ju har en H3O+ koncentration = 1M eftersom saltsyra är en stark syra.
Så långt är det ganska enkelt. Dock är inte öl eller vört obuffrade system som avjonat vatten. I stället innehåller de en mängd joner som hjälper till att stabilisera pH runt ett givet värde, säg 5.2 i vört. Dessa buffrar pH sänkningen (eller höjningen) genom att ta upp eller avge vätejoner runt ett givet pH. Hur mycket pH kommer sänkas vid en given tillsatts syra är alltså även (för vört och öl främst) beroende av koncentrationen buffertjoner i systemet, om den sänks genom spädning krävs alltså mindre syra per volym för att sänka pH.
Lite klarhet! Tänkte försöka kolla hur linjärt det verkligen var så plottade värdena 10^x, men… blev det rätt? http://www.wolframalpha.com/input/?i=plot+%7B(0,10%5E6.1),(0.5,10%5E5.3),(1.0,10%5E4.9),(1.5,10%5E4.6),(2.0,10%5E4.4),(2.5,10%5E4.2)%7D Tänker jag kanske fel om att man kan räkna ut det såhär?
En googling på ”buffering power of wort” ger en del exempel. Några forskningsartiklar, bland annat en nyffsat färsk med öppen access som förklarar lite mer: http://onlinelibrary.wiley.com/doi/10.1002/jib.286/pdf Och en från byo som kanske är lite mer lättläst: http://byo.com/malt/item/1675-advanced-brewing
Slutsatsen verkar vara att det som är bra för dig är att du har en modell som funkar för dig, men tyvärr inte för oss andra med andra bryggförutsättningar :/ [Disclaimer: skummade bara igenom artiklarna]
Jag blir så glad när någon med mer kunskap (eller jag besatt denna kunskap när jag pluggade kemi a och b i gymnasiet men 16 år senare är endast fragment kvar) tar mina inlägg steget längre! Jag tror slutsaten är att i en ren miljö (destvatten) och stark syra så går det att räkna ut mängden syra som behövs tillsättas och då 10ggr med för varje heltal pH som ska sänkas men i en vört är inte denna stegring alls helt förutsägbar eller lätträknad eftersom mäsksammansättningen är konplex med föera olika buffrar.
Vad tror ni om en konklusionen Joel och Anders?
Jag tycker det låter helt rätt. Vattnet och malten går in och buffrar. Palmer snackar ju om vattnets buffertförmåga, och den där artikeln snackar om maltens buffertförmåga. Hur det funkar med mjölksyra vs. saltsyra vet jag däremot inte, där kanske Anders kan fylla i vad som händer? Precis som för dig är det väl ungefär baserat på kemi a+b i ryggen, men för mig 5 år senare.
Hej,nästan då får du en plot av lacalvolym mot 1/H+ koncetrationen (ta ^-pH istället), men det ser nog bättre ut att logaritmera mängden tillsatt lactal istället – då får du en plot av log lactal mot pH. det blir nästan linjärt.
@Lindh 2016-10-23, ja, det låter som en vettig sammanfattning.
@Joel 2016-10-24, skillnaden mellan mjölksyra och saltsyra är att den senare är en så kallad stark syra. Detta innebär att den är fullständigt dissocierad till CL-(negativ jon) och vätejon (H+ / HO3+). Alltså kan mängden tillsatt H+ enkelt beräknas vid tillsats, oavsett pH.
Mjölksyra är en svag syra och är inte fullständigt dissocierad till lactal- och H+ i vatten. Till vilken grad mjölsyran är dissocierad avgörs av dess pKa och omgivningens pH. Grovt kan vi säg att när pH=pKa är 50% av mjölksyran dissocierad till lactal- och H+, om pH > pKa +1 är > 90% av mjölsyran dissocierad och om pH < pKa -1 är 10^(pH-pKa) = A-/HA = 10^(5.4-3.86) = 34.7, dvs koncentrationen dissocierad lactal är ~35 ggr större än ickedissocierad mjölksyra. Så för de pH-värden vi vill ha i mäsken spelar det ingen roll att mjölksyra är en ”svag” syra. Den är ändå i princip fullständigt dissocierad och har lämnat ifrån sig alla vätejoner.
Om vi istället tittar på det lägsta pH som Lindh uppmätte (4.2) kan vi räkna oss till att mjölksyran då var dissocierad i förhållandet A-/HA = 2.2, dvs A-/(A +HA) = 0.7 = 70%. Så vid detta pH har 70% av tillsatt mjölksyra dissocierat och bidrar till sänkningen i pH.
Hm, såg att det blivit redigeringsfel ovan, ska vara:
@Joel 2016-10-24, skillnaden mellan mjölksyra och saltsyra är att den senare är en så kallad stark syra. Detta innebär att den är fullständigt dissocierad till CL-(negativ jon) och vätejon (H+ / HO3+). Alltså kan mängden tillsatt H+ enkelt beräknas vid tillsats, oavsett pH.
Mjölksyra är en svag syra och är inte fullständigt dissocierad till lactal- och H+ i vatten. Till vilken grad mjölksyran är dissocierad avgörs av dess pKa och omgivningens pH. Grovt kan vi säg att när pH=pKa är 50% av mjölksyran dissocierad till lactal- och H+, om pH > pKa +1 är > 90% av mjölksyran dissocierad och om pH < pKa -1 är 10% dissocierad.
Hur förhåller sig detta till de pH värden vi har i mäsk, säg pH=5.4? Mjölksyra har pKa = 3.86, då får vi att förhållandet mellan dissocierad lactal A- och mjölksyra AH är: 10^(pH-pKa) = A-/HA = 10^(5.4-3.86) = 34.7, dvs koncentrationen dissocierad lactal är ~35 ggr större än ickedissocierad mjölksyra. Så för de pH-värden vi vill ha i mäsken spelar det ingen roll att mjölksyra är en ”svag” syra. Den är ändå i princip fullständigt dissocierad och har lämnat ifrån sig alla vätejoner.
Om vi istället tittar på det lägsta pH som Lindh uppmätte (4.2) kan vi räkna oss till att mjölksyran då var dissocierad i förhållandet A-/HA = 2.2, dvs A-/(A +HA) = 0.7 = 70%. Så vid detta pH har 70% av tillsatt mjölksyra dissocierat och bidrar till sänkningen i pH.
[…] med att säga att man kan se på det hela enkelt samtidigt som det är sjukt komplext. Vid mitt senaste omfattande mäskpH-test kom jag ju fram till att mäsken sjunker som mest 0.1 i pH vid betydligt tjockare mäsk än jag […]